生薬 Huaier フアイア(真菌類)の免疫刺激性プロテオグリカンは、Toll 様受容体 4 を介して NF-κB および MAPK シグナルを亢進する
J Biol Chem。2019 2 月 22 日 294(8):2628–2641。
2019 年 1 月 2 日オンライン公開 doi:10.1074 / jbc.RA118.005477
PMCID :PMC6393594
PMID:30602571
翻訳作業:中山今日子
原文のPDFはこちらから
Ailin Yang‡1, Haitao Fan§1, Yanan Zhao‡, Xiaonan Chen‡, Zhixiang Zhu‡, Xiaojun Zha¶, Yunfang Zhao‡,Xingyun Chai‡, Jun Li‡, Pengfei Tu‡2, and Zhongdong Hu‡
From the ‡Modern Research Center for Traditional Chinese Medicine, School of Chinese Materia Medica, Beijing University ofChinese Medicine, No. 11 North Third Ring Road,Chaoyang District, Beijing 100029, China, the §College of Bioengineering, BeijingPolytechnic, Beijing 100029, China, and the ¶Department of Biochemistry and
Molecular Biology, School of Basic Medicine, AnhuiMedical University, Hefei 230032,China Edited by Xiao-Fan Wang
概要
Trametes robiniophila Murr(Huaier フアイア)は、中国での医薬品成分として使用経験の長いキノコであり、癌管理において優れた臨床効果を示す。ただし、Huaier(フアイア)の抗腫瘍成分と基になる分子メカニズムはよくわかっていないままである。Huier(フアイア)水性抽出物から分子量が約 5.59×10 4 Da のプロテオグリカンを単離した。
このプロテオグリカンを TPG-1 と名付け、FTIR および追加の生化学分析を使用し、その総炭水化物およびタンパク質組成がそれぞれ 43.9 および 41.2%であることを確認した。
生化学的アッセイとイムノブロッティングを使用して、マウス RAW264.7 マクロファージを TPG-1 に曝露すると、Toll 様受容体 4(TLR4)依存性 NF-κB 活性化およびマイトジェン活性化タンパク質キナーゼ(MAPK)シグナル伝達を通じて一酸化窒素(NO)、腫瘍壊死因子α(TNFα)、およびインターロイキン-6(IL-6)の産生が促進されることがわかった。注目すべきことに、TPG-1 治療は、おそらく少なくとも部分的には TNFαの血清レベルを増加させ、ヌードマウスの腫瘍への白血球浸潤を促進することにより、ヒト肝癌 HepG2 細胞の腫瘍形成を有意に阻害した。
TPG-1 はまた、肝細胞癌 H22 保有マウスで良好な抗腫瘍活性を示し、これらのマウスにおいて明らかな副作用はなかった。
TPG-1 は、TLR4–NF-κB / MAPK シグナリングカセットの活性化による免疫増強効果を介して、部分的に抗腫瘍活性を発揮すると結論付けた。したがって、TPG-1 は癌免疫療法の有望な候補薬となり得る。
この研究は、TPG-1 プロテオグリカンを抗腫瘍剤として特定し、TPG-1 の分子メカニズムへの知見を提供し、この薬剤を癌治療に適用する潜在的な有用性を示唆するものである。
キーワード:抗がん剤、プロテオグリカン、Toll-like receptor 4(Toll 様受容体 4)(TLR4)、NF-kappaB、マイトジェン活性化プロテインキナーゼ(MAPK)、免疫療法、サイトカイン応答、Huaier(フアイア)、免疫調節、TPG-1、トラメテス、抗腫瘍、TPG- 1
前書き
Trametes robiniophila Murr。(Huaier)は、中国で 1600 年以上にわたって疾患の治療に使用されてきた薬用菌類(キノコ)です。多くの研究において、Huaier(フアイア)は、肝臓癌、胃癌、前立腺癌、大腸癌、乳癌、および肺癌の治療に優れた臨床効果を発揮することが示されている(1-4)。
Huaier(フアイア)水性抽出物の一部の多糖類が抗腫瘍および免疫調節活性を示しています。
たとえば、Huaier(フアイア)の粗多糖類は、AEG-1/ EMT 経路を介して、ヒト肝細胞癌 MHCC97-H 細胞の増殖と浸潤の可能性を遅らせました(5)。Huaier(フアイア)多糖 TP-1 は、HIF-1α/血管内皮増殖因子と AUF-1 / AEG-1 シグナル伝達経路を不活性化することにより、肝細胞癌の増殖と転移を少なくとも部分的に抑制た(6)。さらに、Huaier(フアイア)多糖類 W-NTRP は、ヒト胆管癌細胞の細胞生存率を抑制し、マウス脾細胞の増殖を促進した(7)。ただし、Huaier の抗腫瘍性成分と根本的な分子メカニズムはよく理解されていない。
免疫の強化は、抗腫瘍薬に反応して癌治療において重要な役割を果たす。最近では、天然由来の多糖類/プロテオグリカンがマクロファージなどの免疫エフェクター細胞を活性化することで腫瘍の成長を阻害するという注目が高まり、免疫増強効果のある多糖類/プロテオグリカンから抗腫瘍薬を開発するのは有望な戦略です(8-11)。
この研究では、分子量が約 5.59×10 4 Da のプロテオグリカン TPG-1 を Huaier(フアイア)水性抽出物から単離した。TPG-1 で処理されたマウスマクロファージ様 RAW264.7細胞の上清が、ヒト肝癌 HepG2 および SK-HEP-1 細胞に対して劇的な細胞毒性を示すことを示した。
さらに、TPG-1 は、NO、4腫瘍壊死因子α(TNFα)、およびインターロイキン 6(IL-6)の分泌を、マウスマクロファージ様 RAW264.7 の NF-κB および MAPKシグナル伝達経路の TLR4 依存性活性化を介して促進した。さらに、TPG-1 処理は、HepG2 または H22 細胞の腫瘍形成能を、マウスの腫瘍への白血球の浸潤を促進することを部分的に鈍化させました。
結果
プロテオグリカン TPG-1 の分離、精製、特性評価
糖画分(TS)は、水抽出、除タンパク、エタノール沈殿により、Huaier(フアイア)水性抽出物から得られた。糖画分はさらに、水と 1.0 m NaCl 溶液を含む DEAE-セルロース(DE-52)カラムで連続的に溶出され、pre-TPG-1 が分離された。水で溶出されたプレTPG-1 は、セファロース CL-6B カラムでさらに精製された。その後、それを収集し、さらなる研究のために凍結乾燥した。
HPLC-GPC で検出されたクロマトグラムは、対称的な単一のピークを示し(図 1A )、TPG-1 が均一であることを示した。TPG-1 の平均分子量は、約 5.59×10 4 Da と計算された。TPG-1 の総炭水化物含有量は、フェノールスルホ酸法で測定して 43.93%であった。
図 1:プロテオグリカン TPG-1 の特徴。

A、Huaier(フアイア)のプロテオグリカン TPG-1 の高性能ゲル浸透クロマトグラフィー
B 、TPG-1 の FTIR スペクトル
C 、TPG-1 の UV スペクトル
D および E 、MALDI-TOF-MS による TPG-1 の分析
F 、TPG-1 の CD スペクトル
G 、TPG-1の微細構造観察。
TPG-1 の FTIR スペクトルは、3408 cm -1 付近に強くて幅広い吸収ピークを示しました。これは、タンパク質の N-H 伸縮振動と多糖類のヒドロキシル基の特徴です。2921cm -1 および 2851 cm -1付近で特徴付けられる弱い吸収周波数は、曲げ振動および C–H 伸縮振動として示さた。アシルアミノの C–O 伸縮振動と N–H 曲げ振動を含む、1651.61、1401.08、および 1261.74 cm -1の強い吸収ピークは、それぞれアミド I、II、および III に割り当てられた。1043 cm -1の特定のバンドは、ピラノースリングの O-H 角度可変振動によるものである(図 1 B )。
TPG-1 は 0.1 で処理し、M を選択的解放β脱離、誘導するための NaOH O -結合糖類は、スレオニンおよび/またはセリン残基に結合する。NaOH による O- グリカンの放出後、セリンとスレオニンはアミノアクリル酸とアミノクロトン酸に変わり、240 nm での吸光度が向上した。結果は、TPG-1 には O- 結合型グリカンが存在しないことを示した(図 1C )。
MALDI-TOF-MS によって検出された PNGase F で処理された TPG-1 の分子量は減少しており、TPG-1 が N- グリコシド結合を含んでいたことを示す。さらに、TPG-1 が糖タンパク質であることが示唆された(図 1D および E)。
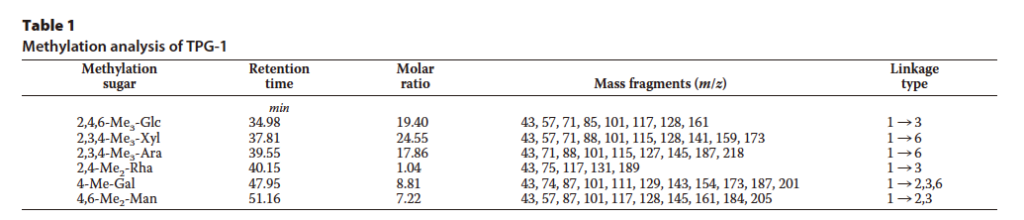
メチル化分析を使用して、TPG-1 の単糖残基間の特定のグリコシド間結合を明らかにした。GC-MS 分析からの TPG-1 の個々のピークは、それらの保持時間と質量スペクトルとの比較によって識別された。表 1 に要約されているように、TPG-1 にはグルコース(Glc)、キシロース(Xyl)、アラビノース(Ara)、ラムノース(Rha)、ガラクトース(Gal)、およびマンノース(Man)が含まれていた。我々の結果は、2,4,6-Me 3 -Glc、2,3,4-Me 3 -Xyl、2,3,4-Me 3 -Ara、2,4-Me 2 -Rha、4-Me-Gal、および 4,6-Me 2 -Man―モル比は 19.40:24.55:17.86:1.04:8.81:7.22― の 6 つのリンクタイプの存在を示した。
表 1 TPG-1 のメチル化分析
さらに、アミノ酸分析では、TPG-1 の総アミノ酸含有量が 41.20%であることを示した。TPG-1 には 17 種類のアミノ酸があり、主要なアミノ酸はグルタミン酸(7.42%)で、アスパラギン酸、グリシン、アルギニン、スレオニン、アラニン、プロリン、セリンがそれに続いた。さらに、TPG-1 の総必須アミノ酸含有量は 9.93%であった。TPG-1 には、リジン、フェニルアラニン、スレオニン、イソロイシン、ロイシン、バリンなどの 6種類の必須アミノ酸が含まれる(表 2)。TPG-1 の二次構造は CD スペクトルによって決定され、その結果は TPG-1 が水溶液中でランダムなコイル構造を示した(図 1F)。
表 2 TPG-1 のアミノ酸組成
TPG-1 の微細構造観察は、原子間力顕微鏡(AFM)によって行われた。結果は、TPG-1が凝集してランダムな鎖構造を形成し、直径 200〜800 nm、高さ 0.8〜3.3 nm の水溶液に均一に分散した棒状の塊を形成したことを示した(図 1 G )。
in vitro でのヒト肝癌 HepG2 および SK-HEP-1 細胞の増殖に対する TPG-1 の効果
まず、ヒト肝癌 HepG2 細胞を、RAW264.7 細胞の上清を TPG-1 の有無にかかわらず、または TPG-1 の有無にかかわらず新鮮な完全培地を用いてさまざまな時点で培養した。
図 2A に示すように、TPG-1 は、対照群と比較して、HepG2 細胞の増殖を阻害が弱かった。ただし、TPG-1 で処理されていない RAW264.7 細胞の上清と比較して、TPG-1 で処理された RAW264.7 細胞の上清は、時間依存的に HepG2 細胞に劇的な細胞毒性を示した。さらに、ヒト肝癌 SK-HEP-1 細胞でも一貫した結果が得られた(図 2B )。この現象は、TPG-1 によって誘導された RAW264.7 細胞からの分泌因子によるものではないかと推測した。
図 2.TPG-1 で処理された RAW264.7 細胞からの上清のヒト肝癌 HepG2 および SK-HEP-1 細胞に対する細胞毒性
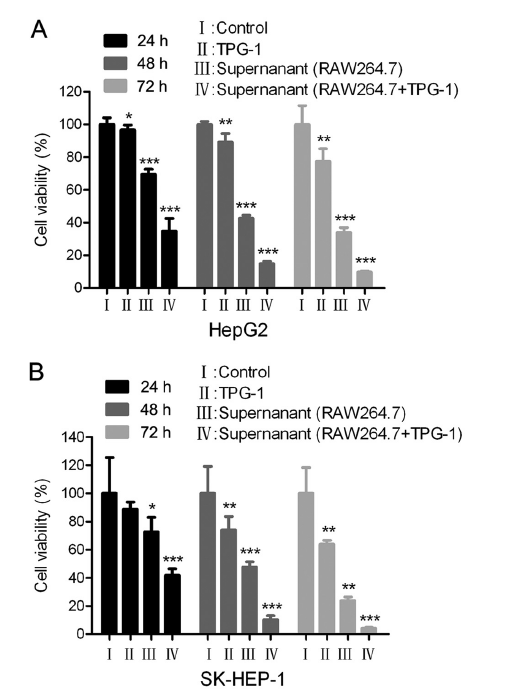
HEP-1 細胞に対する細胞毒性
HepG2(A )または SK-HEP-1(B )細胞を、100μg/ ml TPG-1 ありまたはなしで 24 時間処理した RAW264.7 細胞の上清、または 100μg/ ml TPG -1 ありまたはなしの新鮮な完全培地で、それぞれ 24 時間、48 時間、72 時間培養した。細胞生存率は、MTT アッセイによって測定された。データは 3 つの独立した実験の代表であり、それぞれが少なくとも 3 回繰り返して実行されました。p <0.001*、p <0.05; **、p <0.01; ***エラーバー、信頼区間。
RAW264.7 細胞の NO 産生に対する TPG-1 の影響
NO は免疫応答において最も多様な薬理作用がある物質です(12)。RAW264.7 細胞による NO 産生に対する TPG-1 の効果を調べた。TPG-1 は、RAW264.7 細胞に対して、24時間で 250μg/ ml の濃度まで細胞毒性を示さなかった。しかしながら、TPG-1 は弱い処理時間の延長と RAW 264.7 細胞の増殖を阻害した(図 3 の A )。RAW264.7 細胞によるNO 産生は、用量依存的にではなく、TPG-1 処理によって大幅に刺激された(図 3B)。対照群(4.85±0.34μm)と比較して、RAW264.7 細胞の上清の NO 濃度は、TPG-1(それぞれ 50、100、250、500μg/ ml の濃度)での処理により、22.63±0.45、23.09±0.49、23.54±0.52、および 23.93±1.18μm に劇的に増加した。機作的に、私たちの研究は、RAW264.7 細胞における TPG-1 が誘導性一酸化窒素シンターゼ(iNOS)の mRNAおよびタンパク質レベルを上方制御することを明らかにした(図 3 C および D )。
図 3 RAW264.7 細胞における NO 産生および iNOS 活性に対する TPG-1 の影響
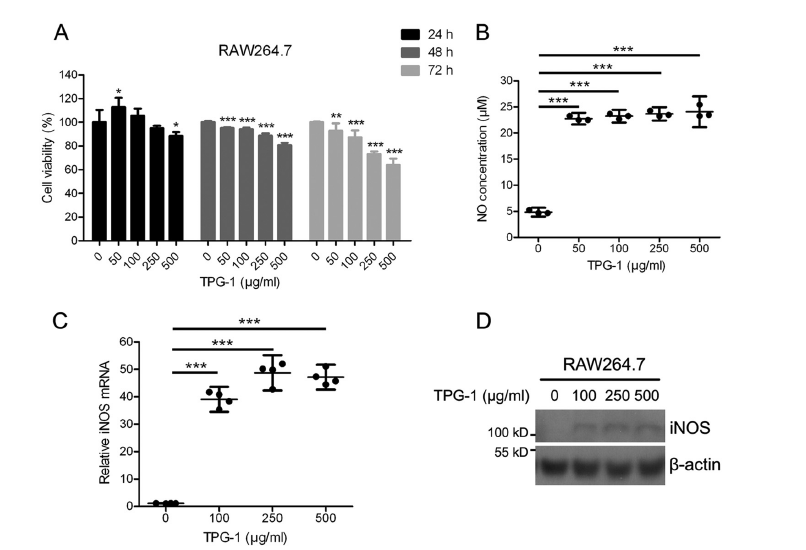
A 、RAW264.7 細胞は、0〜500μg/ ml TPG-1(0、50、100、250、500μg/ ml TPG-1)でそれぞれ 24 時間、48 時間、72 時間処理された。細胞生存率は、MTT アッセイによって測定された。
B 、0〜500μg/ ml TPG-1 で 24 時間処理した RAW264.7 細胞によって生成された NO のレベルを、グリース反応で調べた。
C および D 、トータル RNA および細胞溶解物は、0〜500μg/ ml TPG-1 で 24 時間処理され、定量リアルタイム PCR(C )およびイムノブロッティング(D )にそれぞれかけられた RAW264.7 細胞から抽出された。
データは 3 つの独立した実験の代表であり、それぞれが少なくとも 3 回繰り返し実施した。p <0.001*、p <0.05; **、p <0.01; ***。エラーバー、信頼区間。TPG-1 は、RAW264.7 細胞における TNFα、IL-6、および COX-2 の発現を増加させたTPG-1 の免疫学的活性をさらに調査するために、定量的リアルタイム PCR(qRT-PCR)と ELISA により、TPG-1 に曝された RAW264.7 細胞における TNFαと IL-6 の発現と分泌を調べた。TPG-1 処理は、RAW264.7 細胞における TNFαの mRNA レベルを大幅にアップレギュレートし(図 4A )、RAW264.7 細胞における TPG-1 による処理後、TNFα分泌も用量依存的に増加しました(図 4B )。さらに、TPG-1 は RAW264.7 細胞における IL-6 の発現と分泌を劇的に増強した(図 4 C および D )。シクロオキシゲナーゼ-2(COX-2)は、活性化マクロファージによって放出される免疫因子の一つです(13-14)。図 4(E および F )に示すように、TPG-1 処理により、RAW264.7 細胞の COX-2の mRNA およびタンパク質レベルが増加した。
図 4 RAW264.7 細胞における TNFα、IL-6、および COX-2 の発現に対する TPG-1 の効果
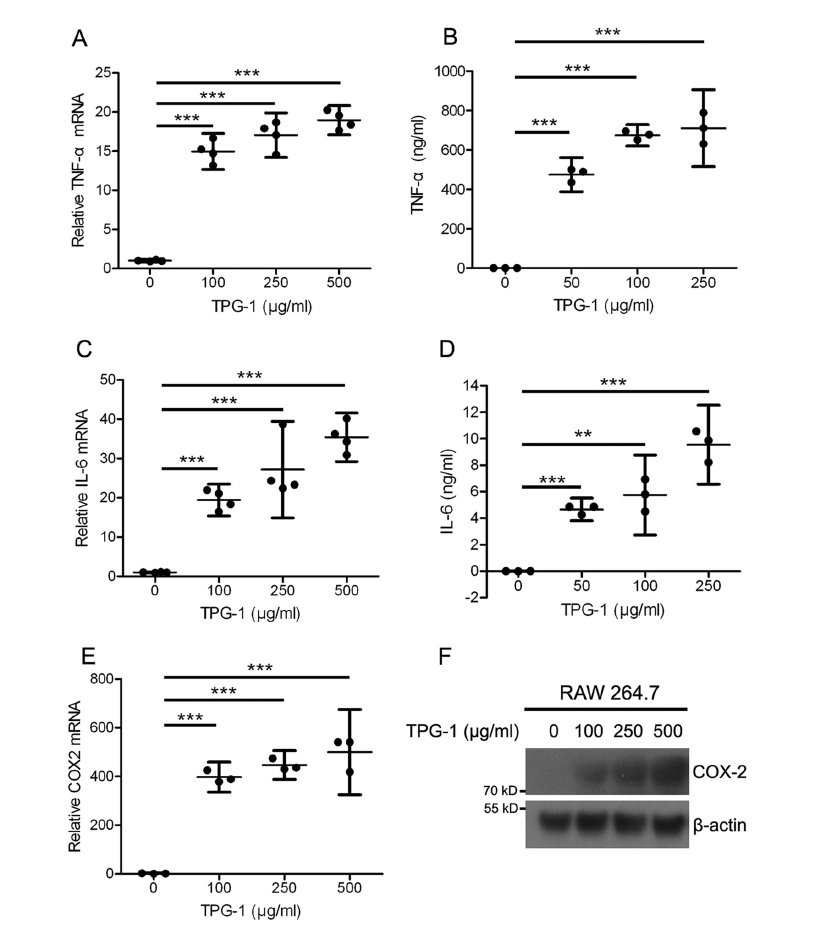
A 、C 、および E 、トータル RNA は、0〜500μg/ ml TPG-1 で 24 時間処理され、定量リアルタイム PCR にかけられた RAW264.7 細胞から抽出された。B および D 、0〜250μg/ ml TPG-1 で 24 時間処理した RAW264.7 細胞の上清中の TNFα(B )または IL-6(D )のレベルを ELISA で測定した。F 、細胞溶解物を 0〜500μg/ ml TPG-1 で 24 時間
処理し、イムノブロッティングを行った RAW264.7 細胞から抽出した。データは 3 つの独立した実験の代表であり、それぞれが少なくとも 3 回繰り返して実施した。p <0.001**、 p <0.01; ***。エラーバー、信頼区間。
TPG-1 処理は、RAW264.7 細胞における NF-κB および MAPK シグナル伝達経路のTLR4依存性活性化をもたらしたTPG-1 の免疫学的活動の根本的なメカニズムを探求するために、RNA-Seq の TPG-1 の有無にかかわらず処理された RAW264.7 細胞から総 RNA を抽出しました。図 5A に示すように、RNA-配列データの分析は、Toll 様受容体シグナル伝達経路、TNF シグナル経路を含む TPG-1 で変調されたトップ 30 の経路、そして NF-κB シグナル伝達経路を示し
た。
これらのシグナル伝達経路は、免疫応答の調節に関与することが同定されている(15-19)。次に、免疫ブロット分析を実行して、RAW264.7 細胞の NF-κB シグナル伝達経路に対する TPG-1 の効果を確認した。TPG-1 が RAW264.7 細胞における IKKα/β、IKBα、および p65 のリン酸化を上方制御し、IKKβ発現も増加させることを示し(図5B )、TPG-1 が NF-κB シグナル伝達経路を活性化したことを示している。また、MAPK シグナル伝達経路は、しばしば、マクロファージの活性化に関与することが報告されている(20-22)。TPG-1 処理は、RAW264.7 細胞における p38、ERK、および JNK のリン酸化を著しく増強した(図 5 C )。したがって、TPG-1 による免疫増強は、RAW264.7 細胞における NF-κB および MAPK シグナル伝達経路の活性化によるものであることが結果から示唆された。
図 5 TPG-1 処理は、RAW264.7 細胞で NF-κB および MAPK シグナル伝達の TLR4 依存性活性化を誘導
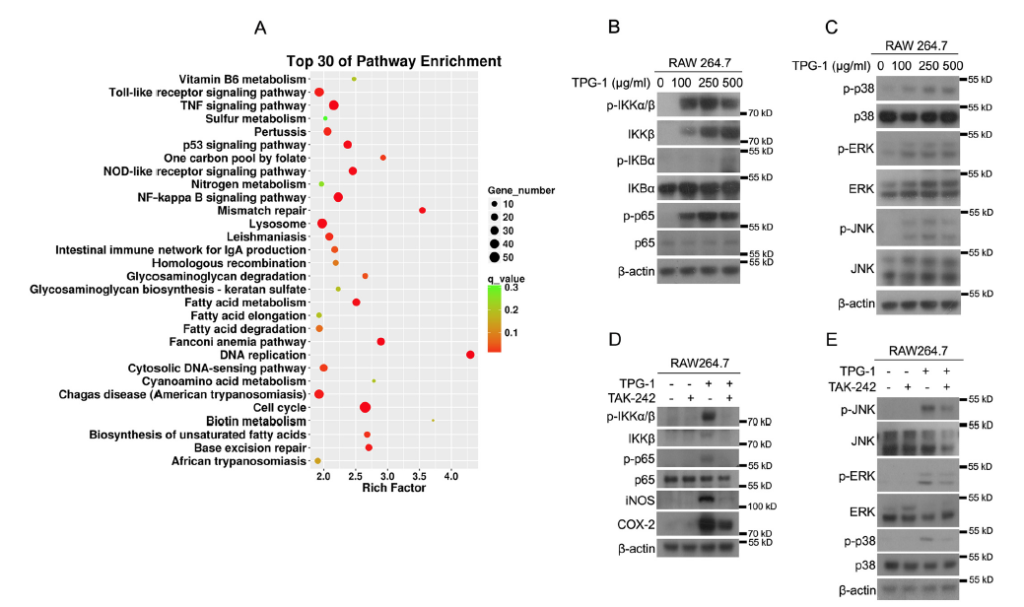
A 、総 RNA は、TPG-1 の有無にかかわらず処理された RAW264.7 細胞から抽出され、RNA シーケンスに供され、上位 30 の濃縮 KEGG 経路を含む、KEGG 濃縮分析からの差分遺伝子の散布図が表示される。
B および C 、細胞溶解物を 0〜500μg/ ml TPG-1で 48 時間処理した RAW264.7 細胞から抽出し、NF-κB シグナル伝達経路または MAPKシグナル伝達経路の示されたタンパク質のイムノブロッティングに供した。D および E 、細胞溶解物は、1μmTAK -242 の非存在下または存在下で 100μg/ ml TPG-1 の存在下または非存在下で 24 時間処理され、イムノブロッティングに供された RAW264.7 細胞から抽出された。データはそれぞれ 3 回の実験を行った。
RNA-Seq の結果は、Toll 様受容体シグナル伝達経路が TPG-1 によって制御される主要な経路の 1 つであることを示した。また、Toll 様受容体 4(TLR4)は、NF-κB およびMAPK シグナル伝達の活性化に必須であるとの多くの報告がある。(10、20-22)。したがって、次に、TLR4 が TPG-1 によって誘導される NF-κB および MAPK シグナル伝達 経路の活性化に関係しているかどうかを調査した。図5 D に示すように、TPG-1 によって誘導された p-IKKα/β、IKKβ、p-p65、iNOS、および COX-2 の発現の増加は、RAW264.7 セル内の TLR4 阻害剤である TAK-242 での処理によって顕著に阻害された(25)。さらに、TPG-1 に曝された RAW264.7 細胞におけるアップレギュレートされたMAPK シグナル伝達は、TAK-242 処理によって著しく損なわれた(図 5E )。したがって、TPG-1 によって誘導される NF-κB および MAPK の活性化は、RAW264.7 細胞ではTLR4 に依存した。
TPG-1 によって誘導される TNFα、IL-6、NO のアップレギュレーションは TLR4 によって媒介された次に TRAW4 が TNFα、IL-6、および RAW264.7 細胞の TPG-1 によって誘導されるNO のアップレギュレーションに関係しているかどうかを調査した。TPG-1 によって誘導される TNFαの分泌の増加は、RAW264.7 細胞での TAK-242 による処理によって有意に抑制された(図6A )。TAK-242 の非存在下または存在下で TPG-1 で処理したRAW264.7 細胞での IL-6 または NO の分泌でも同様の結果が観察された(図6、B および C )。さらに、RNAi を使用して、TLR4 が TPG-1 に曝された RAW264.7 細胞の TNFα、IL-6、および NO の増加レベルに関与していたかどうかを調査した。
TLR4 の発現は、TLR4 を標的とする siRNA でトランスフェクトされた RAW264.7 細胞でわずかに減少し(図6D )、TLR4 の枯渇は RAW264.7 細胞の増殖に変化をもたらしませんでした(図6E )。一貫して、TLR4 発現の減少は、TPG-1 に曝露された RAW264.7 細胞における TNFα、IL-6、および NO の分泌の増加を減衰させた(図6、F–H )。総称して、TPG-1 処理によって誘導される TNFα、IL-6、および NO の生産の増加は、RAW264.7細胞の TLR4 によって媒介された。
図6 TPG-1 によって誘導される TNFα、IL-6、NO のアップレギュレーションは、TLR4 によって媒介
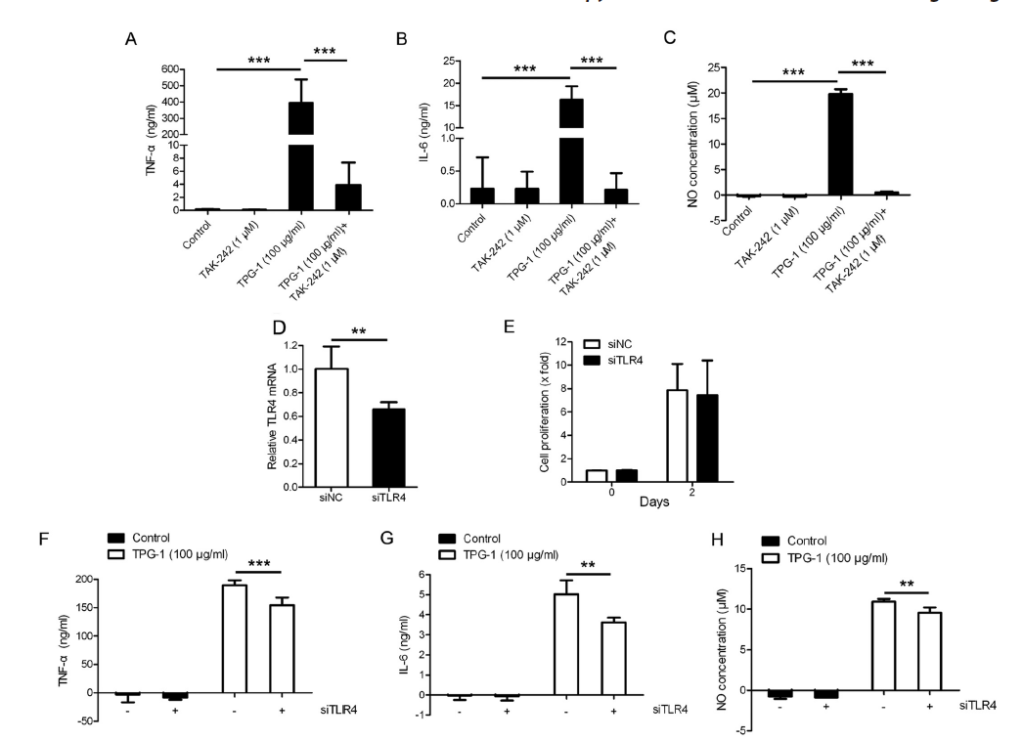
A-C 、TNFα(レベル A )、IL-6(B )、または NO(C は)1μm の非存在下または存在下で 100μg/ ml の TPG-1 の有無にかかわらず処理された RAW264.7 細胞によって産生された TAK -242 の 24 時間は、ELISA またはグリース反応によって測定された。
D 、総RNA は TLR4 siRNA またはネガティブコントロール siRNA でトランスフェクトされたRAW264.7 細胞から抽出され、定量的リアルタイム PCR にかけられた。 E 、TLR4siRNA またはネガティブコントロール siRNA でトランスフェクトされた RAW264.7 細胞の増殖を MTT アッセイで測定した。
F–H 、TLR4 siRNA またはネガティブコントロール siRNA でトランスフェクトされた RAW264.7 細胞を 100μg/ ml TPG-1 の有無にか かわらず 24 時間処理し、TNFα(F )、IL-6(G )、または NO のレベル(H )上清中の ELISA またはグリース反応によって測定した。データは 3 つの独立した実験の代表であり、それぞれが少なくとも 3 回繰り返して実行された。p <0.001**、p <0.01; ***。エラー バー、信頼区間。
TPG-1 の in vivo 抗腫瘍活性
腫瘍形成性の高いヒト肝癌 HepG2 細胞が採用され、生体内で TPG-1 の抗腫瘍効果を評価するために使用される異種移植腫瘍モデルが確立された。
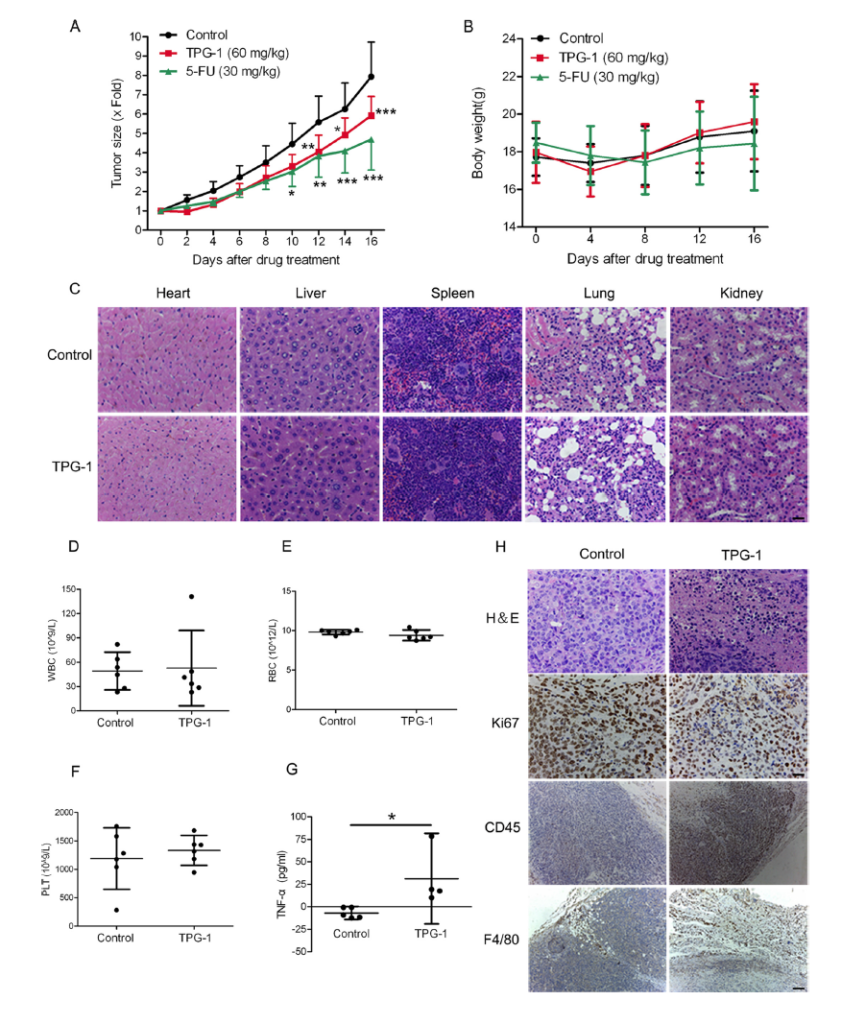
図7A に示したように、TPG-1 処理は、ヌードマウスにおける HepG2 細胞の腫瘍形成能を有意に鈍らせた。さらに、TPG-1 による治療はヌードマウスに有意な体重減少をもたらさなかった(図 7B )。
さらに、H&E 染色分析は、TPG-1 が心臓、肝臓、脾臓、肺、および腎臓を含む主要な臓器に明らかな細胞毒性が現れないことを示した(図7C )。さらに、血液分析により、TPG-1 による治療後のヌードマウスには血液毒性がないことが明らかになった。(図 7、D–F )。TPG-1 処理は、ヌードマウスの TNFαの血清レベルも増加させた(図7G )。
図7H に示すように、Ki67(増殖マーカー)(26)、CD45(白血球マーカー)(27)、および F4 / 80(マクロファージマーカー)(28)の免疫組織化学(IHC)分析により、TPG- 1 での治療は、HepG2 細胞の増殖を阻害し、ヌードマウスの HepG2 細胞に由来する腫瘍への白血球の浸潤を促進した。
図7 TPG-1 は、副作用なしに、HepG2 細胞の in vivo 発癌能を有意に抑制A は、ヌードマウスベアリングの HepG2 腫瘍異種移植片を、TPG-1(IP、60 MG / kgを、一日一回)または 5-FU(IP、を 30mg / kg で、週 3 回)で処理した。 B 、薬物治療中のヌードマウスの体重。 C 、TPG-1 ありまたはなしで処理されたヌードマウスの主要臓器の H&E 染色。スケールバー、50μm。 D–F 、TPG-1 ありまたはなしで処理されたヌードマウスからの白血球、赤血球、および血小板の数。 G、TPG-1を用いてまたは用いずに処置されたヌードマウスにおけるTNFαの血清レベルは、ELISAによって測定。
H 、H&E 染色および TPG-1 処理ありまたはなしのヌードマウスからの腫瘍組織の免疫組織化学分析。スケールバー、50μm(上)または 200μm(下)。p <0.001*、p <0.05; **、p <0.01; ***。エラーバー、信頼区間。
また、肝細胞癌 H22 ベアリング昆明系マウスにおける TPG 1 の抗腫瘍効果を調査しました。図 8 の A に示したように、TPG-1 処置は、有意に昆明系マウスにおけるマウス肝癌 H22 細胞の発癌性を阻害した。体重曲線は、TPG-1 処理が昆明系マウスの体重を弱く阻害することを示した(図8B )。さらに、H&E 染色分析は、TPG-1 が主要な臓器に対して明らかな細胞毒性を示さないことを示した(図8C )。さらに、腫瘍組織の IHC 分析は、昆明系マウスにおける H22 細胞の増殖が TPG-1 によって抑制されたことを示唆し、TPG-1 処理はまた、昆明系マウスにおける H22 細胞に由来する腫瘍への白血球の浸潤を
促進した(図 8D)。まとめると、この結果は、TPG-1 の免疫増強効果が TPG-1 の抗腫瘍活性に寄与するという考えを裏付けた。
図8 TPG-1 は、昆明系マウスにおけるマウス肝癌 H22 細胞の発癌性を劇的に抑制

A は、肝癌 H22 担持昆明マウスを、TPG-1(IP、60 MG / kg を、一日一回)または 5-FU(IP、を 30mg / kg で、週 3 回)で処理した。
B 、薬物治療中の昆明系マウスの体重。
C 、TPG-1 ありまたはなしで処理した昆明系マウスの主要臓器の H&E 染色。スケールバー、50μm。
D 、H&E 染色および TPG-1 処理ありまたはなしで処理された昆明系マウスの腫瘍組織の免疫組織化学分析。スケールバー、50μm(左)または 200μm(右)。p <0.001**、p <0.01; ***。エラーバー、信頼区間。
討論
天然由来の多糖類/プロテオグリカンの抗癌効果は、最近ますます注目を集めています。
ここで、我々は Huaier(フアイア)水抽出物から新しいプロテオグリカン TPG 1 を分離した。さらなる調査により、TPG-1 は、NF-κB および MAPK シグナル伝達経路のTLR4 依存性活性化を介した免疫増強効果により、部分的に良好な抗腫瘍活性を示すことが明らかになった。
マクロファージは免疫系の中心的な細胞であり、NO、TNFα、IL-6 などのいくつかのサイトカインを放出することにより、腫瘍に対する防御に不可欠な要素です(29)。多くの多糖類/プロテオグリカンがマクロファージの活性化を促進することによって免疫活動を 高めるという多くの報告がある。
たとえば、Salicornia 多糖類は、RAW264.7 細胞での NO 産生と iNOS 転写を大幅に促進する(30)。Poria cocos から単離されたプロテオグリカンは、TNFαのアップレギュレーションを通じて RAW 264.7 細胞の活性化を誘導する(31)。また、免疫調節効果は Huaier(フアイア)の抗腫瘍活性の基礎となる機構の 1 つであることが報告されている(2、7、32)。
我々の研究は、Huaier(フアイア)から分離されたプロテオグリカン TPG-1 が、RAW264.7 細胞における NO、TNFα、および IL-6の産生を有意に増加させることを示した。さらに、TPG-1 処理は、RAW264.7 細胞における iNOS および COX-2 の発現を劇的にアップレギュレートした。マクロファージの活性化によって分泌は増加しない。腫瘍免疫療法において癌細胞を殺すための重要な要素である。また、iNOS の活性化は、マクロファージにおける NO 産生の増加を引き起こす(33、34)。TNFαと IL-6 はどちらも免疫応答に関与する多機能サイトカインです。
活性化されたマクロファージによって産生される TNFαは、腫瘍壊死を誘発する可能性がある(35)。IL-6 は抗腫瘍活性を有するサイトカインであると報告されている(36)。
COX-2 は、免疫応答で活性化されるシクロオキシゲナーゼです。TNFαはマクロファージでの COX-2 発現を増強し、COX-2 は IL-6 の産生を正に調節する(37-39)。したがって、COX-2 の上昇は TPG-1 による IL-6 の上方制御に関与している可能性がある。まとめると、プロテオグリカン TPG-1 は強力な免疫刺激剤です。
多糖類による免疫増強のメカニズムに関する多くの文献がある。レンゲ多糖類は、マクロファージにおける TLR4 シグナル伝達経路の活性化を通じて、NO、TNFα、およびIL-6 の分泌を促進した(10)。Sargassum fusiforme 多糖類は、マクロファージの TLR/NF-κB シグナル伝達経路によって部分的にサイトカイン産生を誘導する(40)。霊芝アトラム多糖(PSG-1)は、ROS /ホスファチジルイノシトール 3-キナーゼ/ AKT、ROS /MAPK、および TLR4 を介した ROS /NF-κB シグナル伝達経路のアップレギュレーションを通じて、TNFαの分泌を促進する(41)。TLR4 は、自然免疫応答とサイトカイン産
生に重要な役割を果たす。TLR4 が多糖類/プロテオグリカンキキョウと P.のココス存在下でのマクロファージの活性化に必須であることが報告されている(31、42)。多くの研究により、NF-κB および MAPK シグナル伝達の活性化は TLR4 によって媒介されること、また、NF-κB および MAPK シグナル伝達経路は、正の TNFα、IL-6、および NOの分泌の調節因子、ならびに iNOS および COX-2 の発現因子であることが実証されてい
る。(43-46)。この研究では、RAW264.7 細胞における TPG-1 による NF-κB およびMAPK シグナル伝達経路の活性化に TLR4 が必要であることを示した。
さらに、我々の研究により、TPG-1 によって誘発される TNFα、IL-6、および NO のアップレギュレーションが、薬理学的および遺伝的アプローチを通じて TLR4 によって媒介されることが明らかになった。したがって、我々は TPG-1 が TLR4–NF-κB / MAPK シグナル伝達カセットのアップレギュレーションを通じて良好な免疫増強効果を発揮することを提案した。
多糖類・プロテオグリカンなど、がん免疫療法薬の研究が注目されています。現在、レンチナン、クレスチン(PSK)、シゾフィランなどいくつかの抗腫瘍性多糖/プロテオグリカン薬物が、市場に出ており、臨床試験中である。(8、47、48)。
我々は、TPG-1 治療が異種移植マウスモデルにおいてヒト肝癌 HepG2 細胞の腫瘍形成能を有意に阻害することを見出した。さらに、TPG-1 による治療後のマウスの体重、主要臓器、および血液に対する明らかな副作用はありません。TNFαは免疫応答とアポトーシスに密接に関連している。TNFαは、癌治療で良い臨床効果を示すことがわかった(49、50)。ここで、我々はTPG-1 処理がヌードマウスの TNFαの血清レベルを増加させ、それが HepG2 細胞由来の
腫瘍における細胞増殖の阻害に関与している可能性を発見した。
さらに、TPG-1 で処理した RAW264.7 細胞の上清は、ヒト肝癌 HepG2 および SK-HEP-1 細胞に対して有意な細胞毒性を示した。興味深いことに、TPG-1 処理により、マウスの腫瘍への白血球の浸潤が明らかに促進された。さらに、TPG-1 の同様の抗腫瘍効果は、肝細胞癌 H22 ベアリング昆明系マウスでも観察された。
総称して、TPG-1 は in vitro および in vivo で免疫機能を増強することができる。TPG-1 の抗腫瘍効果は部分的に免疫増強に起因することを提案しま
す。したがって、Huaier(フアイア)のプロテオグリカン TPG-1 は、がん免疫療法の有望な候補薬となる。
要約すると、分子量が約 5.59×10 4 Da のプロテオグリカン TPG-1 が Huaier (フアイア)から単離された。TPG-1 の総炭水化物含有量は 43.93%であり、グルコース、キシロース、アラビノース、ラムノース、ガラクトース、およびマンノースが 19.40:24.55:17.86:1.04:8.81:7.22 のモル比で構成されている。
TPG-1 のタンパク質含有量は 41.20%で、N- グリコシド結合によってグリカンにリンクされている。さらに、TPR-1は、TLR4-NF-κB/ MAPK シグナル伝達カセットの活性化によって媒介される免疫増強効果を介して、部分的に良好な抗腫瘍活性を発揮することを示した(図 9)。ただし、
TPG-1 が Huaier(フアイア)の臨床効果における主要な成分であるかどうかはまだ不明である。TPG-1 は、癌治療の新しい候補薬になる可能性がある。
我々の研究は、TPG-1の分子メカニズムへの洞察を提供し、この薬剤を癌免疫療法に適用する潜在的な有用性を示唆している。
図 9 略図 Huaier(フアイア)由来のプロテオグリカン TPG-1 の免疫賦活効果の基本メカニズム

TPG-1 は、TNF-α、IL-6、および NO のアップレギュレーションに起因する免疫増強効果により、NF-κB および MAPK シグナル伝達経路の TLR4 依存性活性化によって媒介される抗腫瘍活性を部分的に発揮した。
実験手順
試薬と抗体
DMEM、FBS、PBS、および 0.25%トリプシン-EDTA は、Corning Life Sciences(Corning、NY)から入手した。TAK-242 は、アラジン上海生物化学技術有限公司(中国、上海)から入手。5-FU は Sigma(ドイツ、ダイゼンホーフェン)から入手。MTT はBiodee Co.、Ltd.(北京、中国)より入手。iNOS(カタログ番号 13120)、COX-2(カタログ番号 4842)、p-IKKα/β(カタログ番号 2697)、IKKβ(カタログ番号 8943)、p-IκBα(カタログ番号 2859)に対する抗体、 IκBα(カタログ番号 4814)、p-p65(カタログ番号 3033)、p65(カタログ番号 8242)、p-p38(カタログ番号 4511)、p38(カタログ番号 8690)、p-ERK1 / 2(カタログ番号 4370)、ERK1 / 2(カタログ番号4695)、p-JNK(カタログ番号 4668)、および JNK(カタログ番号 9252)は、Cell Signaling Technology(Danvers、MA)から購入した。抗β-アクチン抗体(カタログ番号sc-47778)およびホースラディッシュペルオキシダーゼ標識抗マウス(カタログ番号 sc-2005)またはウサギ(カタログ番号 sc-2004)抗体は、Santa Cruz Biotechnology、Inc.から購入した。 (テキサス州ダラス)。
細胞培養
ヒト肝癌細胞株 SK-HEP-1 および HepG2 は、American Type Culture Collection(バージニア州マナッサス)から。マウスマクロファージ様細胞株 RAW264.7 は、中国医学科学院(北京、中国)の基礎医学研究所の細胞培養センターに由来。細胞は、10%FBS および1%ペニシリン/ストレプトマイシンを含む DMEM で 37°C、5%CO 2 で維持した。
プロテオグリカン TPG-1 の分離と精製
Huaier(T. robiniophila Murr。)(フアイア)の舐剤軟膏は、Gaitianli Medicine Co.、Ltd.(中国江蘇省)から入手。Huaier(フアイア)の軟膏を蒸留水に溶解して 8%希釈液を得、次に Sevage 試薬を添加して遊離タンパク質を除去した(51)。60%エタノールで分離した沈殿物を遠心分離(3000 x g で 10 分間)で回収し、蒸留水に溶解した後、減圧濃縮して過剰の溶媒残留物を除去し、真空凍結乾燥した。TS を蒸留水に溶解し、その溶液を DEAE セルロース(DE-52)のカラムにロードし、蒸留水と 1.0 m NaCl で連続的に溶出した。1.0 m NaCl 溶出の画分を透析し、さらに分離し、蒸留水で 1 ml・min -1 の流量
で溶出するセファロース CL-6B カラムで精製して、1 つの主要画分を得た。この画分は、HPLC-GPC-ELSD によって単一の対称ピークとして特徴付けられ、次に凍結乾燥して、TPG-1 という名前の精製プロテオグリカンとなる。
プロテオグリカン TPG-1 の特徴
IR スペクトル分析
TPG-1 の FTIR スペクトルは、臭化カリウム(KBr)ディスク法を使用し、FTIR 分光計(Jasco Corp.、東京、日本)で 400〜4000 cm -1 の範囲で検出された。
グリコシド結合分析
TPG-1 が 0.5 に溶解した M の NaBH 4 0.1 M の NaOH を、18 時間 25°Cでインキュベートした。NaOH 処理なしの TPG-1 を対照として使用した。NaOH 処理および未処理のサンプルは、200〜400 nm の範囲の UV 分光光度計(Jasco)で検出されました。TPG-1 を重炭酸アンモニウム(NH 4 HCO 3 )(50 mm)に溶解し、グリコシダーゼ PNGase F(New England Biolabs)で 37°C で 16 時間処理しました。加水分解反応は、95°C で10 分間加熱することで停止した。分子量は、MALDI-TOF-MS(AB Sciex 4700)を使用して分析した。グリコシダーゼ加水分解のない TPG-1 を対照として使用した。
メチル化分析
フェノールスルホ酸法を使用して、TPG-1 の総炭水化物含有量を決定した。TPG-1 は、以前にいくつかの変更を加えて説明したように完全にメチル化されていた。TPG-1(7mg)を 10 ml の乾燥メタノールに溶解し、蒸発乾固させた。乾燥した TPG-1 を DMSO(10 ml)に溶解し、NaOH(600 mg)と混合し、2.5 時間超音波処理した。ヨウ化メチル(500μl)を光から離して反応混合物に加え、10 分間超音波処理した。この手順を 3 回繰り返し、混合物をさらに 1 時間超音波処理した。反応生成物に計 7ml の蒸留水と 3ml のクロロホルムを加え、振とう混合後、遠心分離した。クロロホルム層を蒸留水で 3 回洗浄し
た。
その後、メチル化の完了は、FTIR による O-H バンド(3200〜3600 cm -1 )の消失によって証明された。完全にメチル化されたサンプルを、10 ml の 2 m TFA で 6 時間加水分解した。加水分解物を 20 mg の NaBH 4 で還元し、40°C で 30 分間保持した後、100μlの氷酢酸を添加して還元作用を停止しました。生成物を、減圧下で乾燥させた後、2ml の無水酢酸および 2ml のピリジンでアセチル化した。95°C で 1 時間インキュベートした後、アセチル化誘導体を蒸発乾固させ、2 ml のクロロホルムで抽出しました。最後に、GC-MS(GCMS-QP 2010、島津、京都、日本)を使用して、酢酸アルジトールを分析した。
分子量の検出
プロテオグリカン TPG-1 の平均分子量は、TSK®G5000PWXL(300×7.8 mm)を使用して HPLC-GPC-ELSD で測定し、0.8 ml・min -1 の流量の脱イオン水で溶出した。プロテオグリカン TPG-1 の平均分子量は、デキストラン標準(Sigma、1、12、50、80、270、670、および 1100 kDa)の保持時間と比較して計算した。
アミノ酸組成分析
TPG-1 のアミノ酸組成は以下のように決定した。15.55 mg の TPG-1 を 10 ml の6 m HCl で 110°C で 24 時間加水分解した。次に、サンプル 1 ml を取り出して乾燥させ、0.02 m HCl 500μl を加えてサンプルを溶解した。遠心分離(12,000× g で 10 分間)後、上清をろ過し、アミノ酸組成を L-8800 Hitachi High Speed Amino Acid Analyzer(東京、日本)で分析した。
CD スペクトルの分析
TPG-1 を蒸留水に溶解し、25°C で 190〜260 nm の範囲の CD 分光偏光計(Chirascan、Applied Photophysics、Leatherhead、英国)で検出した。
微細構造観察
AFM(BioScope Catylyst NanoScope V、Bruker、Billerica、MA)を使用して、TPG-1の微細構造を観察した。TPG-1 を蒸留水(1μg/ ml)に溶解し、室温で 6 時間撹拌した。5μl の溶液を、劈開したばかりの雲母基板に滴下し、室温で乾燥した。AFM は接触モードで決定した。チューブ型圧電スキャナー(5×5μm)と Si 3 N 4 プローブ(オリンパス、日本)を使用。画像は、ラインあたり 1.0 Hz のスキャン速度で 256×256 ピクセルと同時に生成した。
細胞生存率アッセイ
細胞を 96 ウェルプレートに 4000〜10,000 細胞/ウェルの密度で播種した。翌日、細胞を指示された濃度の TPG-1 でさまざまな時間処理。次に、上清を除去し、MTT を各ウェルに最終濃度 0.5 mg / ml で加えた。37°C で 4 時間のインキュベーション後、150μl のDMSO を各ウェルに加え、光学密度をマイクロプレートリーダー(PerkinElmer LifeSciences)で 490 nm で測定した。
RNA シーケンスとデータ分析
製造元のプロトコルに従って、TRIzol(Invitrogen)を使用して、TPG-1(100μg/ml)ありまたはなしで 24 時間処理した RAW264.7 細胞から総 RNA を抽出した。RNA シーケンシングは、上海バイオテクノロジー社(中国、上海)が Illumina Hiseq x Ten で実施。Hisat2 および Stringtie ソフトウェアを使用してデータ分析を実施した。
qRT-PCR
トータル RNA は、表示された濃度の TPG-1 で 24 時間 TRIzol を使用して処理されたRAW264.7 細胞から抽出され、製造元のプロトコルに従って PrimeScript RT 試薬キット(TaKaRa、大連、中国)を使用して cDNA に変換した。TransStart Tip Green qPCR Kit(TransGen Biotech、北京、中国)を使用して、4μl の cDNA を定量 PCR のテンプレートとして使用した。プライマーの配列は以下のとおりです。
iNOS forward, 5′-CGGCAAACATGACTTCAGGC-3′;
iNOS reverse, 5′-GCACATCAAAGCGGCCATAG-3′;
TNFα forward, 5′-CCCCTTTATTGTCTACTCCT-3′;
TNFα reverse, 5′-AAAGCCCATTTGAGTCCTTG-3′;
IL-6 forward, 5′-AAATAGTCCTTCCTACCCCAA-3′;
IL-6 reverse, 5′-CCGAGTAGATCTCAAAGTGAC-3′;
COX-2 forward, 5′-TCAATACTGGAAGCCGAGCA-3′;
COX-2 reverse, 5′-CACCCCTTCACATTATTGCAGA-3′;
TLR4 forward, 5′-CAAGGGATAAGAACGCTGAGA-3′;
TLR4 reverse, 5′-GCAATGTCTCTGGCAGGTGTA-3′;
GAPDH forward, 5′-GCGACTTCAACAGCAACTCC-3′;
GAPDH reverse, 5′-CACCCTGTTGCTGTAGCCGT-3′.
NO の決定
RAW264.7 細胞を 96 ウェルプレートに 80,000 細胞/ウェルの密度で播種した。翌日、細胞を指示された濃度の TPG-1 で 24 時間処理した。NO の量は、培養上清中の亜硝酸塩濃度を調べることにより評価できる。亜硝酸塩のレベルは、製造業者のプロトコルに従って、一酸化窒素アッセイキット(Applygen、北京、中国)を使用したグリース反応で測定した。
ELISA
RAW264.7 細胞を 6 ウェルプレートに播種した。翌日、細胞を指示された濃度の TPG-1で 24 時間処理した。細胞培養上清を収集し、上清中に分泌された TNFαおよび IL-6 のレベルを、TNFαおよび IL-6 ELISA キット(Boster、武漢、中国)で製造元の指示に従って調べた。
イムノブロッティング
RAW264.7 細胞を冷 PBS で 2 回洗浄し、溶解バッファー(10%グリセロール、10mm Tris(pH 6.8)、2%SDS、および 100 mm DTT)を含む氷上で収穫し、98°C で 10分間煮沸した。タンパク質レベルは、以前に記載されているようにイムノブロット分析によって検出した(52)。
手短に言えば、細胞溶解物を SDS-PAGE で分離し、ポリフッ化ビニリデン膜に移した。その後、膜を TBST で 3〜5%の脱脂粉乳を使用して室温で 1 時間ブロックし、一次抗体と 4°Cで一晩インキュベートしました。次に、メンブレンを西洋ワサビペルオキシダーゼ標識二次抗体と室温で 2 時間インキュベートした後、化学発光を検出した。
RNAi
siRNA は GenePharma(中国、上海)から合成された。6 ウェルプレートで培養されたRAW264.7 細胞に、製造業者のプロトコルに従って Lipofectamine 2000(Thermo FisherScientific)を使用して siRNA をトランスフェクトした。siRNA 配列は以下のとおりであった:TLR4(マウス)、5′-GAAUUGUAUCGCCUUCUUATT-3 ‘; 陰性対照(スクランブル siRNA)、5’-UUCUCCGAACGUGUCACGUTT-3 ‘。
TPG-1 治療
ヌードマウス(BALB / c、4〜5 週齢)および昆明系マウス(4〜5 週齢)は、BeijingVital River Laboratory Animal Technology Co.、Ltd から入手した。皮下腫瘍モデルは、前述のように確立した(53)。200μl のダルベッコ変法イーグル培地中の合計 2×10 6 個のHepG2 細胞または 8×10 6 個のマウス肝癌 H22 細胞を、ヌードマウスまたは昆明系マウスの右後部背面領域にそれぞれ皮下接種した。マウスを無作為に 3 つのグループに分け、腹腔内注射によって薬物で処理した。各コホートで 6 匹のマウスを使用した。
3 つのグループは次のとおり。
(i)PBS、1 日 1 回。
(ii)1 日 1 回 60 mg / kg TPG-1
(iii)30 mg /kg 5-FU、週 3 回。
腫瘍の増殖を測定し、初期体積に正規化した。動物実験は、北京中国医学大学倫理委員会によって承認された動物の使用と管理に関するガイドラインに従って実施した。
血液分析
TPG-1 の有無にかかわらず処理されたヌードマウスから血液サンプルを収集した。白血球、赤血球、血小板の数は、Sysmex XS-800i 自動血液分析装置(神戸、日本)で調べた。
IHC 分析
免疫組織化学的染色は、以前に記載されたように行った(54)。簡単に言えば、TPG-1の有無にかかわらず処理されたマウスの主要臓器または腫瘍組織を 4%パラホルムアルデヒドで固定し、パラフィンに包埋した。続いて、パラフィン切片を、示されたタンパク質の H&E 染色および免疫組織化学分析に供した。
統計分析
両側スチューデントの t 検定を使用して 2 つのグループ間の差を分析し、分散の双方向分析を使用して複数のグループを比較した。データ分析には、GraphPad Prism バージョン 5.0 ソフトウェアを使用した。データはすべての図で平均±95%信頼区間を表す。 p <0.05 は統計的に有意である。
著者の役割
AY と HF は実験を行い、データを分析して、原稿を書いた。Yanan Zhao、X。Chen、ZZ、XZ、および Yunfang Zhao が実験を行い、データを分析した。X. Chai と JL はデータを分析し、原稿を修正した。PT と ZH は、プロジェクトを考案し、実験を設計し、原稿を修正した。すべての著者が最終原稿を読んで承認した。
この研究は、中国国家自然科学財団助成金 81403147 および中央大学助成金のための基礎研究資金 2015-JYB-XYQ-004 によってサポートされた。著者は、この記事の内容と利益相反がないことを宣言する。
4 使用される略語は次のとおりです。
NO 一酸化窒素
FBS ウシ胎児血清
TLR4 Toll 様受容体 4
MAPK マイトジェン活性化タンパク質キナーゼ
TNF-α 腫瘍壊死因子-α
IL-6 インターロイキン-6
qRT-PCR 定量的リアルタイム PCR
IHC 疫組織化学
iNOS 誘導性一酸化窒素シンターゼ
COX-2 シクロオキシゲナーゼ-2
ELSD 蒸発光散乱検出
GPC ゲル浸透クロマトグラフィー
AFM 原子間力顕微鏡
ERK 細胞外シグナル調節キナーゼ
JNK c-Jun N 末端キナーゼ
p- リン酸化
iNOS 誘導性一酸化窒素シンターゼ
H&E ヘマトキシリンとエオシン
ROS 活性酸素種
DMEM ダルベッコの修正イーグルの培地
5-FU 5-フルオロウラシル
MTT 3-(4,5-ジメチルチアゾール-2-イル)-2,5-ジフェニルテトラゾリウムブロミド
Xyl キシロース
Ara アラビノース
Rhar ラムノース
Man マンノース
PNGase F ペプチド:N- グリコシダーゼ F
Ip 腹腔内
参考文献
1. Chen Q., Shu C., Laurence A. D., Chen Y., Peng B. G., Zhen Z. J., Cai J. Q., Ding Y. T.,
Li L. Q., Zhang Y. B., Zheng Q. C., Xu G. L., Li B., Zhou W. P., Cai S. W., et al.
(2018) Effect of Huaier granule on recurrence after curative resection of HCC: a
multicentre, randomised clinical trial. Gut 67, 2006–2016 10.1136/gutjnl-2018-315983
[PubMed] [CrossRef] [Google Scholar]
2. Song X., Li Y., Zhang H., and Yang Q. (2015) The anticancer effect of Huaier
(Review). Oncol. Rep. 34, 12–21 10.3892/or.2015.3950 [PubMed] [CrossRef] [Google
Scholar]
3. Yang A., Zhao Y., Wang Y., Zha X., Zhao Y., Tu P., and Hu Z. (2018) Huaier suppresses
proliferative and metastatic potential of prostate cancer PC3 cells via downregulation of
Lamin B1 and induction of autophagy. Oncol. Rep. 39, 3055–3063 [PubMed] [Google
Scholar]
4. Hu Z., Yang A., Su G., Zhao Y., Wang Y., Chai X., and Tu P. (2016) Huaier restrains
proliferative and invasive potential of human hepatoma SKHEP-1 cells partially through
decreased Lamin B1 and elevated NOV. Sci. Rep. 6, 31298 10.1038/srep31298 [PMC free
article] [PubMed] [CrossRef] [Google Scholar]
5. Zheng J., Li C., Wu X., Liu M., Sun X., Yang Y., Hao M., Sheng S., Sun Y., Zhang H.,
Long J., Liang Y., and Hu C. (2014) Huaier polysaccharides suppresses hepatocarcinoma
MHCC97-H cell metastasis via inactivation of EMT and AEG-1 pathway. Int. J. Biol.
Macromol. 64, 106–110 10.1016/j.ijbiomac.2013.11.034 [PubMed] [CrossRef] [Google
Scholar]
6. Li C., Wu X., Zhang H., Yang G., Hao M., Sheng S., Sun Y., Long J., Hu C., Sun X., Li L.,
and Zheng J. (2015) A Huaier polysaccharide restrains hepatocellular carcinoma growth and
metastasis by suppression angiogenesis. Int. J. Biol. Macromol. 75, 115–120
10.1016/j.ijbiomac.2015.01.016 [PubMed] [CrossRef] [Google Scholar]
7. Sun Y., Sun T., Wang F., Zhang J., Li C., Chen X., Li Q., and Sun S. (2013) A
polysaccharide from the fungi of Huaier exhibits anti-tumor potential and
immunomodulatory effects. Carbohydr. Polym. 92, 577–582 10.1016/j.carbpol.2012.09.006
[PubMed] [CrossRef] [Google Scholar]
8. Ooi V. E., and Liu F. (2000) Immunomodulation and anti-cancer activity of
polysaccharide-protein complexes. Curr. Med. Chem. 7, 715–729
10.2174/0929867003374705 [PubMed] [CrossRef] [Google Scholar]
9. Tan B. K., and Vanitha J. (2004) Immunomodulatory and antimicrobial effects of some
traditional chinese medicinal herbs: a review. Curr. Med. Chem. 11, 1423–1430
10.2174/0929867043365161 [PubMed] [CrossRef] [Google Scholar]
10. Zhou L., Liu Z., Wang Z., Yu S., Long T., Zhou X., and Bao Y. (2017) Astragalus
polysaccharides exerts immunomodulatory effects via TLR4-mediated MyD88-dependent signaling pathway in vitro and in vivo. Sci. Rep. 7, 44822 10.1038/srep44822 [PMC free
article] [PubMed] [CrossRef] [Google Scholar]
11. Lu H., Yang Y., Gad E., Wenner C. A., Chang A., Larson E. R., Dang Y., Martzen M.,
Standish L. J., and Disis M. L. (2011) Polysaccharide krestin is a novel TLR2 agonist that
mediates inhibition of tumor growth via stimulation of CD8 T cells and NK cells. Clin.
Cancer Res. 17, 67–76 10.1158/1078-0432.CCR-10-1763 [PMC free article] [PubMed]
[CrossRef] [Google Scholar]
12. Bogdan C. (2001) Nitric oxide and the immune response. Nat. Immunol. 2, 907–916
10.1038/ni1001-907 [PubMed] [CrossRef] [Google Scholar]
13. Zhang C. X., and Dai Z. R. (2011) Immunomodulatory activities on macrophage of a
polysaccharide from Sipunculus nudus L. Food Chem. Toxicol. 49, 2961–2967
10.1016/j.fct.2011.07.044 [PubMed] [CrossRef] [Google Scholar]
14. Karnjanapratum S., and You S. (2011) Molecular characteristics of sulfated polysaccharides from Monostroma nitidum and their in vitro anticancer and
immunomodulatory activities. Int. J. Biol. Macromol. 48, 311–318
10.1016/j.ijbiomac.2010.12.002 [PubMed] [CrossRef] [Google Scholar]
15. Aderem A., and Ulevitch R. J. (2000) Toll-like receptors in the induction of the innate
immune response. Nature 406, 782–787 10.1038/35021228 [PubMed] [CrossRef] [Google
Scholar]
16. Akira S., and Takeda K. (2004) Toll-like receptor signalling. Nat. Rev. Immunol. 4, 499–
511 10.1038/nri1391 [PubMed] [CrossRef] [Google Scholar]
17. Akira S., Takeda K., and Kaisho T. (2001) Toll-like receptors: critical proteins linking
innate and acquired immunity. Nat. Immunol. 2, 675–680 10.1038/90609 [PubMed]
[CrossRef] [Google Scholar]
18. Li Q., and Verma I. M. (2002) NF-κB regulation in the immune system. Nat. Rev.
Immunol. 2, 725–734 10.1038/nri910 [PubMed] [CrossRef] [Google Scholar]
19. Aggarwal B. B. (2003) Signalling pathways of the TNF superfamily: a double-edged
sword. Nat. Rev. Immunol. 3, 745–756 10.1038/nri1184 [PubMed] [CrossRef] [Google
Scholar]
20. Mosser D. M., and Edwards J. P. (2008) Exploring the full spectrum of macrophage
activation. Nat. Rev. Immunol. 8, 958–969 10.1038/nri2448 [PMC free article] [PubMed]
[CrossRef] [Google Scholar]
21. Long T., Liu Z., Shang J., Zhou X., Yu S., Tian H., and Bao Y. (2018) Polygonatum
sibiricumpolysaccharides play anti-cancer effect through TLR4-MAPK/NF-κB signaling
pathways. Int. J. Biol. Macromol. 111, 813–821 10.1016/j.ijbiomac.2018.01.070 [PubMed]
[CrossRef] [Google Scholar]
22. Wei W., Xiao H. T., Bao W. R., Ma D. L., Leung C. H., Han X. Q., Ko C. H., Lau C. B.,
Wong C. K., Fung K. P., Leung P. C., Bian Z. X., and Han Q. B. (2016) TLR-4 may mediate
signaling pathways of Astragalus polysaccharide RAP induced cytokine expression of
RAW264.7 cells. J. Ethnopharmacol. 179, 243–252 10.1016/j.jep.2015.12.060 [PubMed]
[CrossRef] [Google Scholar]
23. Zhang G., and Ghosh S. (2001) Toll-like receptor-mediated NF-κB activation: a
phylogenetically conserved paradigm in innate immunity. J. Clin. Invest. 107, 13–19
10.1172/JCI11837 [PMC free article][PubMed] [CrossRef] [Google Scholar]
24. Pålsson-McDermott E. M., and O’Neill L. A. (2004) Signal transduction by the
lipopolysaccharide receptor, Toll-like receptor-4. Immunology 113, 153–162
10.1111/j.1365-2567.2004.01976.x[PMC free article] [PubMed] [CrossRef] [Google
Scholar]
25. Matsunaga N., Tsuchimori N., Matsumoto T., and Ii M. (2011) TAK-242 (resatorvid), a
small-molecule inhibitor of Toll-like receptor (TLR) 4 signaling, binds selectively to TLR4
and interferes with interactions between TLR4 and its adaptor molecules. Mol.
Pharmacol. 79, 34–41 10.1124/mol.110.068064 [PubMed] [CrossRef] [Google Scholar]
26. Guzman G., Alagiozian-Angelova V., Layden-Almer J. E., Layden T. J., Testa G.,
Benedetti E., Kajdacsy-Balla A., and Cotler S. J. (2005) p53, Ki-67, and serum α feto-
protein as predictors of hepatocellular carcinoma recurrence in liver transplant
patients. Mod. Pathol. 18, 1498–1503 10.1038/modpathol.3800458 [PubMed]
[CrossRef] [Google Scholar]
27. Trowbridge I. S., and Thomas M. L. (1994) CD45: an emerging role as a protein
tyrosine phosphatase required for lymphocyte activation and development. Annu. Rev.
Immunol. 12, 85–116 10.1146/annurev.iy.12.040194.000505 [PubMed]
[CrossRef] [Google Scholar]
28. Austyn J. M., and Gordon S. (1981) F4/80, a monoclonal antibody directed specifically
against the mouse macrophage. Eur. J. Immunol. 11, 805–815 10.1002/eji.1830111013
[PubMed] [CrossRef] [Google Scholar]
29. Zong A., Cao H., and Wang F. (2012) Anticancer polysaccharides from natural
resources: a review of recent research. Carbohydr. Polym. 90, 1395–1410
10.1016/j.carbpol.2012.07.026 [PubMed] [CrossRef] [Google Scholar]
30. Lee K. Y., Lee M. H., Chang I. Y., Yoon S. P., Lim D. Y., and Jeon Y. J. (2006) Macrophage activation by polysaccharide fraction isolated from Salicornia herbacea. J. Ethnopharmacol. 103, 372–378 10.1016/j.jep.2005.08.037 [PubMed]
[CrossRef] [Google Scholar]
31. Chang H. H., Yeh C. H., and Sheu F. (2009) A novel immunomodulatory protein from Poria cocosinduces Toll-like receptor 4-dependent activation within mouse peritoneal
macrophages. J. Agric. Food Chem. 57, 6129–6139 10.1021/jf9011399 [PubMed]
[CrossRef] [Google Scholar]
32. Li C., Wu X., Zhang H., Yang G., Hao M., Sheng S., Sun Y., Long J., Hu C., Sun X., Li
L., and Zheng J. (2015) A Huaier polysaccharide inhibits hepatocellular carcinoma growth
and metastasis. Tumour Biol. 36, 1739–1745 10.1007/s13277-014-2775-2 [PubMed]
[CrossRef] [Google Scholar]
33. Aktan F. (2004) iNOS-mediated nitric oxide production and its regulation. Life Sci. 75,
639–653 10.1016/j.lfs.2003.10.042 [PubMed] [CrossRef] [Google Scholar]
34. Wink D. A., Hines H. B., Cheng R. Y., Switzer C. H., Flores-Santana W., Vitek M. P.,
Ridnour L. A., and Colton C. A. (2011) Nitric oxide and redox mechanisms in the immune
response. J. Leukoc. Biol. 89, 873–891 10.1189/jlb.1010550 [PMC free article] [PubMed]
[CrossRef] [Google Scholar]
35. Locksley R. M., Killeen N., and Lenardo M. J. (2001) The TNF and TNF receptor
superfamilies: integrating mammalian biology. Cell 104, 487–501 10.1016/S0092-
8674(01)00237-9 [PubMed] [CrossRef] [Google Scholar]
36. Akira S., Hirano T., Taga T., and Kishimoto T. (1990) Biology of multifunctional
cytokines: IL 6 and related molecules (IL 1 and TNF). FASEB J. 4, 2860–2867
10.1096/fasebj.4.11.2199284 [PubMed] [CrossRef] [Google Scholar]
37. Nakao S., Ogtata Y., Shimizu E., Yamazaki M., Furuyama S., and Sugiya H.
(2002) Tumor necrosis factor α (TNF-α)-induced prostaglandin E2 release is mediated by
the activation of cyclooxygenase-2 (COX-2) transcription via NFκB in human gingival
fibroblasts. Mol. Cell Biochem. 238, 11–18 10.1023/A:1019927616000 [PubMed]
[CrossRef] [Google Scholar]
38. Medeiros R., Figueiredo C. P., Pandolfo P., Duarte F. S., Prediger R. D., Passos G. F.,
and Calixto J. B. (2010) The role of TNF-α signaling pathway on COX-2 upregulation and
cognitive decline induced by β-amyloid peptide. Behav. Brain Res. 209, 165–173
10.1016/j.bbr.2010.01.040 [PubMed] [CrossRef] [Google Scholar]
39. Bukata S. V., Gelinas J., Wei X., Rosier R. N., Puzas J. E., Zhang X., Schwarz E. M., Song
X. Y., Griswold D. E., and O’Keefe R. J. (2004) PGE2 and IL-6 production by fibroblasts in
response to titanium wear debris particles is mediated through a Cox-2 dependent
pathway. J. Orthop. Res. 22, 6–12 10.1016/S0736-0266(03)00153-0 [PubMed]
[CrossRef] [Google Scholar]
40. Chen X., Yu G., Fan S., Bian M., Ma H., Lu J., and Jin L. (2014) Sargassum fusiforme polysaccharide activates nuclear factor κ-B (NF-κB) and induces cytokine
production via Toll-like receptors. Carbohydr. Polym. 105, 113–120
10.1016/j.carbpol.2014.01.056 [PubMed] [CrossRef] [Google Scholar]
41. Yu Q., Nie S. P., Wang J. Q., Yin P. F., Huang D. F., Li W. J., and Xie M. Y. (2014) Toll-like receptor 4-mediated ROS signaling pathway involved in Ganoderma atrum polysaccharide-induced tumor necrosis factor-α secretion during macrophage
activation. Food Chem. Toxicol. 66, 14–22 10.1016/j.fct.2014.01.018 [PubMed]
[CrossRef] [Google Scholar]
42. Yoon Y. D., Han S. B., Kang J. S., Lee C. W., Park S. K., Lee H. S., Kang J. S., and Kim
H. M. (2003) Toll-like receptor 4-dependent activation of macrophages by polysaccharide
isolated from the radix of Platycodon grandiflorum. Int. Immunopharmacol. 3, 1873–1882
10.1016/j.intimp.2003.09.005 [PubMed] [CrossRef] [Google Scholar]
43. Bonizzi G., and Karin M. (2004) The two NF-κB activation pathways and their role in
innate and adaptive immunity. Trends Immunol. 25, 280–288 10.1016/j.it.2004.03.008
[PubMed] [CrossRef] [Google Scholar]
44. Vallabhapurapu S., and Karin M. (2009) Regulation and function of NF-κB
transcription factors in the immune system. Annu. Rev. Immunol. 27, 693–733
10.1146/annurev.immunol.021908.132641 [PubMed] [CrossRef] [Google Scholar]
45. Pearson G., Robinson F., Beers Gibson T., Xu B. E., Karandikar M., Berman K., and
Cobb M. H. (2001) Mitogen-activated protein (MAP) kinase pathways: regulation and
physiological functions. Endocr. Rev. 22, 153–183 10.1210/edrv.22.2.0428 [PubMed]
[CrossRef] [Google Scholar]
46. Kawai T., and Akira S. (2006) TLR signaling. Cell Death Differ. 13, 816–825
10.1038/sj.cdd.4401850 [PubMed] [CrossRef] [Google Scholar]
47. Fisher M., and Yang L. X. (2002) Anticancer effects and mechanisms of polysaccharide-
K (PSK): implications of cancer immunotherapy. Anticancer Res. 22, 1737–1754
[PubMed] [Google Scholar]
48. Krosl G., and Korbelik M. (1994) Potentiation of photodynamic therapy by
immunotherapy: the effect of schizophyllan (SPG). Cancer Lett. 84, 43–49 10.1016/0304-
3835(94)90356-5 [PubMed] [CrossRef] [Google Scholar]
49. Eggermont A. M., de Wilt J. H., and ten Hagen T. L. (2003) Current uses of isolated
limb perfusion in the clinic and a model system for new strategies. Lancet Oncol. 4, 429–437
10.1016/S1470-2045(03)01141-0 [PubMed] [CrossRef] [Google Scholar]
50. Old L. J. (1985) Tumor necrosis factor (TNF). Science 230, 630–632
10.1126/science.2413547 [PubMed] [CrossRef] [Google Scholar]
51. Staub A. M. (1965) Removal of protein-Sevag method. Methods Carbohydr. Chem. 5, 5–
6 [Google Scholar]
52. Hu Z., Wang Y., Huang F., Chen R., Li C., Wang F., Goto J., Kwiatkowski D. J.,
Wdzieczak-Bakala J., Tu P., Liu J., Zha X., and Zhang H. (2015) Brain-expressed X-linked 2
is pivotal for hyperactive mechanistic target of rapamycin (mTOR)-mediated
tumorigenesis. J. Biol. Chem. 290, 25756–25765 10.1074/jbc.M115.665208 [PMC free
article] [PubMed] [CrossRef] [Google Scholar]
53. Sun Q., Chen X., Ma J., Peng H., Wang F., Zha X., Wang Y., Jing Y., Yang H., Chen R.,
Chang L., Zhang Y., Goto J., Onda H., Chen T., et al. (2011) Mammalian target of
rapamycin up-regulation of pyruvate kinase isoenzyme type M2 is critical for aerobic
glycolysis and tumor growth. Proc. Natl. Acad. Sci. U.S.A. 108, 4129–4134
10.1073/pnas.1014769108 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
54. Jin F., Jiang K., Ji S., Wang L., Ni Z., Huang F., Li C., Chen R., Zhang H., Hu Z., and
Zha X. (2017) Deficient TSC1/TSC2-complex suppression of SOX9-osteopontin-AKT
signalling cascade constrains tumour growth in tuberous sclerosis complex. Hum. Mol.
Genet. 26, 407–419 [PubMed] [Google Scholar]
